(一)工作细胞的跨膜电位及其形成机制
1.静息电位和动作电位人和哺乳动物的心室肌细胞和骨骼肌细胞一样,在静息状态下膜两侧呈极化状态,膜内电位比膜外电位约低90mV,但两者的动作电位有明显不同。骨骼肌细胞动作电位的时程很短,仅持续几个毫秒,复极速度与去极速度几乎相等,记录曲线呈升支和降支基本对称的尖锋状。心室肌细胞动作电位的主要特征在于复极过程比较复杂,持续时间很长,动作电位降支与升支很不对称。通常用0、1、2、3、4等数字分别代表心室肌细胞动作电位和静息电位的各个时期。
(1)除极(去极)过程:除极过程又称0期。在适宜的外来刺激作用下,心室肌细胞发生兴奋,膜内电位由静息状态下的-90mV迅速上升到+30mV左右,即肌膜两侧原有的极化状态被消除并呈极化倒转,构成动作电位的升支。除极相很短暂,仅占1-2ms,而且除极幅度很大,为120mV;可见,心室肌细胞的除极速度很快,膜电位的最大变化速率可达800-1000V/s。
(2)复极过程:当心室细胞除极达到顶峰之后,立即开始复极,但整个复极过程比较缓慢,包括电位变化曲线的形态和形成机制均不相同的三个阶段:
1期复极:在复极初期,仅出现部分复极,膜内电位由+30mV迅速下降到0mV左右,故1期又称为快速复极初期,占时约10ms。0期除极和1期复极这两个时期的膜电位的变化速度都很快,记录图形上表现为尖锋状,故在心肌细胞习惯上常把这两部分合称为锋电位。
2期复极:当1期复极膜内电位达到0mV左右之后,复极过程就变得非常缓慢,膜内电位基本上停滞于0mV左右,细胞膜两侧呈等电位状态,记录图形比较平坦,故复极2期又称为坪或平台期,持续约100-150ms,是整个动作电位持续时间长的主要原因,是心室肌细胞以及其它心肌细胞的动作电位区别于骨骼肌和神经纤维的主要特征。
3期复极;2期复极过程中,随着时间的进展,膜内电位以较慢的速度由0mV逐渐下降,延续为3期复极,2期和3期之间没有明显的界限。在3期,细胞膜复极速度加快,膜内电位由0mV左右较快地下降到-90mV,完成复极化过程,故3期又称为快速复极末期,占时约100-150ms 。
4期:4期是膜复极完毕、膜电位恢复后的时期。在心室肌细胞或其它非自律细胞,4期内膜电位稳定于静息电位水平,因此,4期又可称为静息期。
2.形成机制与骨骼肌一样,离子在细胞膜两侧不均匀分布所形成的浓度梯度(浓度差)(表4-1)、驱动相应离子经过当时开放的细胞膜上特殊离子通道的跨膜扩散,是心肌细胞跨膜电位形成的主要基础,只是由于心肌细胞膜上具有数目较多的离子通道,跨膜电位形成机制中涉及的离子流远比骨骼肌要复杂得多。在电生理学中,电流的方向以正离子在膜两侧的流动方向来命名,正离子外流或负离子内流称外向电流,正离子内流或负离子外流称内向电流。外向电流导致膜内电位向负电性转化,促使膜复极,内向电流导致膜内电位向正电性转化,促使膜除极。
表4-1 心肌细胞中各种主要离子的浓度及平衡电位值
| 离 子 | 浓度(mmo1/L) 细胞内液 细胞外液 | 内/外比值 | 平衡电位(mV) (由Nernst公式计算) | |
| Na+ | 30 | 140 | 1:4,6 | +41 |
| K+ | 140 | 4 | 35:1 | -94 |
| Ca2+ | 10-4 | 2 | 1:20,000 | +132 |
| CI- | 30 | 104 | 1:3.5 | -33 |
除离子跨膜扩散之外,由细胞上离子泵所实现的离子主动转运和离子交换,在心肌细胞电活动中也占有重要地位。
心室肌细胞静息电位的形成机制与骨骼肌相同,也就是说,尽管肌膜两侧上述几种离子都存在有浓度梯度,但静息状态下肌膜对K+的通透性较高,而对其它离子的通透性很低,因此,K+顺其浓度梯度由膜内向膜外扩散所达到的平衡电位,是静息电位的主要来源。
肌膜钠通道的大量开放和膜两侧浓度梯度及电位梯度的驱动从而出现Na+快速内流,是心室肌细胞0期去极形成的原因。进一步对整个去极过程进行分析就可以看到,与骨骼肌一样,在外来刺激作用下,首先引起部分电压门控式Na+通道开放和少量Na+内流,造成肌膜部分去极化,膜电位绝对值下降;而当膜电位由静息水平(膜内-90mV)去极化到阈电位水平(膜内-70mV)时,膜上Na+通道开放概率明显增加,出现再生性Na+内流(参看第二章),于是Na+顺其浓度梯度和电位梯度由膜外快速进入膜内,进一步使膜去极化,膜内电位向正电性转化。决定0期去极的Na+通道是一种快通道,它不但激活、开放的速度很快,而且激活后很快就失活,当膜除极到一定程度(omV左右)时,Na+通道就开始失活而关闭,最后终止Na+的继续内流。快Na+通道可被河豚毒(TTX)所阻断。由于Na+通道激活速度非常之快,又有再生性循环出现,这就是心室肌细胞0期去极速度很快,动作电位升支非常陡峭的原因。正因为如此,从电生理特性上,尤其是根据0期除极的速率,将心室肌细胞(以及具有同样特征的心肌细胞)称为快反应细胞,其动作电位称为快反应电位,以区别于以后将要介绍的慢反应细胞和慢反应电位。
复极1期是在0期除极之后出现的快速而短暂的复极期,此时快钠通道已经失活,同时激活一种一过性外向电流(Ito),从而使膜迅速复极到平台期电位水平(0~-20mV)。至于Ito的离子成分,70年代曾认为是Cl-(即Cl-内流)。近年来,根据Ito可被四乙基铵和4-氨基吡啶等K+通道阻滞剂所阻断的研究资料,认为K+才是Ito的主要离子成分。也就是说,由K+负载的一过性外向电流是动作电位初期快速复极的主要原因。目前对Ito的通道特征尚不十分清楚,但有资料提示,膜除极和细胞内Ca2+都可以使Ito的通道激活。
平台期初期,膜电位稳定于0mV左右,随后才非常缓慢地复极。膜电位的这种特征是由于平台期同时有内向电流和外向电流存在,初期,两种电流处于相对平衡状态,随后,内向电流逐渐减弱,外向电流逐渐增强,总和的结果是出现一种随时间推移而逐渐增强的、微弱的外向电流,导致膜电位缓慢地向膜内负电性转化。电压钳研究结果表明,在心室肌等快反应细胞,平台期外向离子流是由K+携带的(称Ik1)。静息状态下,K+通道的通透性很高,在0期除极过程中,K+的通透性显著下降,K+外流大大减少,除极相结束时,K+的通透性并不是立即恢复到静息状态下的那种高水平,而是极其缓慢地、部分地恢复,K+外流也就由初期的低水平而慢慢增加(图4-6)。平台期内向离子流主要是由Ca2+(以及Na+)负载的。已经证明,心肌细胞膜上有一种电压门控式的慢Ca2+通道,当膜除极到-40mV时被激活,Ca2+顺其浓度梯度向膜内缓慢扩散从而倾向于使膜除极,与此同时,上述微弱的K+外流倾向于使膜复极化,在平台期早期,Ca2+的内流和K+的外流所负载的跨膜正电荷时相等,膜电位稳定于1期复极所达到的电位水平。随着时间推移,Ca2+通道逐渐失活,K+外流逐渐增加,其结果,出膜的净正电荷量逐渐增加,膜内电位于是逐渐下降,形成平台期晚期。此后,Ca2+通道完全失活,内向离子流终止,外向K+流进一步增强,平台期延续为复极3期,膜电位较快地回到静息水平,完成复极化过程。
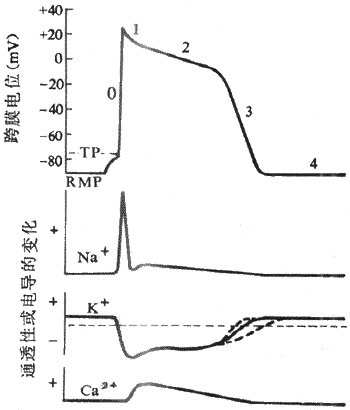
图4-6 心室肌细胞跨膜电位及其形成的离子机制
RMP:静息膜电位 TP :阈电位
肌膜上有Ca2+通道,是心室肌细胞和其它心肌细胞的重要特征。大量研究表明:①从一个心肌细胞的总体而言(不是从单个通道而言),Ca2+通道的激活、失活,以及再复活所需时间均比Na通道要长,经 Ca2+通道跨膜的Ca2+内流,起始慢,平均持续时间也较长。因此相应称为慢通道和慢内向离子流;②慢通道也是电压门控式的,激活慢通道的阈电位水平(-50~-35mV)高于快Na通道(-70~-55mV);③它对某些理化因素的敏感性和反应性不同于快通道,可被Mn2+和多种Ca2+阻断剂(如异博定,D-600等)所阻断,而对于可以阻断快通道的河豚毒和细胞膜的持续低极化状态(膜内电位-50Mv左右)却并不敏感。各种心肌细胞的肌膜上都具有这种慢通道,由此形成的跨膜离子流,是决定心肌细胞电活动以及心室肌等快反应细胞动作电位平台期的最重要的内向离子流之一。
平台期之后,膜的复极逐渐加速,因此时Ca2+通道已经失活,在平台期已经激活的外向K+流出现随时间而递增的趋势。其原因是,3期的复极K+流是再生性的,K+的外流促使膜内电位向负电性转化,而膜内电位越负,K+外流就越增高。这种正反馈过程,导致膜的复极越来越快,直至复极化完成。
在4期内,心室肌细胞膜电位基本上稳定于静息电位水平,但是,离子的跨膜转运仍然在活跃进行。因为,动作电位期间有Na+和Ca2+进入细胞内,而K+外流出细胞,因此,只有从细胞内排出多余的Na+和Ca2+,并摄入K+才能恢复细胞内外离子的正常浓度梯度,保持心肌细胞的正常兴奋性。这种离子转运是逆着浓度梯度进行的主动转运过程。像骨骼肌一样,通过肌膜上Na+-K+泵的作用,将Na+的外运和K+的内运互相耦联形成Na+-K+转运,同时实现Na+和K+的主动转运。关于主动转运Ca2+的转运机制,还没有完全弄清楚。目前大多数作者认为,Ca2+的逆浓度梯度的外运是与Na+的顺浓度的内流相耦合进行的。形成Na+-Ca2+交换。Ca2+的这种主动转运是由Na+ 的内向性浓度梯度提供能量的,由于Na+内向性浓度梯度的维持是依靠Na+-K+泵而实现的,因此,Ca2+主动转运也是由Na+-K+泵提供能量的。在4期开始后,膜的上述主动转运功能加强,细胞内外离子浓度梯度得以恢复。总的来看,这时转运过程引起的跨膜交换的电荷量基本相等,因此,膜电位不受影响而能维持稳定。
| 上一页:一、心肌细胞的生物电现象 |
| 当前页:(一)工作细胞的跨膜电位及其形成机制 |
| 下一页:(二)自律细胞的跨膜电位及其形成机制 |