三、病理变化
动脉壁的年龄变化:据国内研究,早在3个月胎龄时即见到主动脉内弹力膜分层,中膜浅层SMC空过弹力膜窗孔进入内膜,其后SMC增生,产生胶原、弹性纤维及蛋白多糖。内膜随着年龄增长而逐渐增厚。此外,在动脉杈或分支开口处常见小块白色增厚区,称为内膜垫(intimal cushion)。内膜垫由SMC、胶原纤维及蛋白多糖组成,可能是对血流剪应力的反应。据病理普查结果表明,动脉粥样硬化病变的发生与年龄的关系十分密切。动脉杈、分支开口及血管弯曲的凸面为病变的好发部位。
1.脂纹 脂纹(fatty streak)是动脉粥样硬化的早期病变。据尸检普查,9岁以下儿童的主动脉脂纹检出率为11.5%,10~19岁为48.96%。肉眼观,主动脉的脂纹常见于其后壁及分支开口处,为帽针头大小斑点及宽约1~2mm、长短不一的黄色条纹,不隆起或稍微隆起于内膜表面。
脂纹的形成多先有高脂血症,高脂血症或其它有害因子可造成内皮损伤,使其表面糖萼变薄,内皮细胞间间隙增宽。LDL与内皮细胞的高亲和性受体结合而被摄取,通过胞浆,进入内皮下间隙,并被内皮细胞及SMC释放的氧自由基氧化修饰,产生氧化LDL(OX-LDL)及氧化Lp(a)[OX-Lp(a)]。
在动脉分杈、分支开口处以及变曲动脉的凸面的血流剪应力减低,并可出现涡流,这使单核细胞易离开轴流与内皮接触。已知内皮细胞能分泌几种粘附分子,例如细胞间粘附分子(intercellular adhesion molecule-1,ICAM-1)及血管粘附分子(vascular adhesion molecule-1,VCAM-1)。ICAM-1可与白细胞表面的受体β2整合素(β2integrin,包括LFA-1及MAC-1)结合,VCAM-1可与白细胞的受体(VLA-4)结合,从而使单核细胞粘附于内皮表面。
单核细胞迁入内皮下间隙受多种因素影响。其中最重要的是SMC分泌的单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1),对单核细胞有很强的趋化活性。此外,动脉壁细胞产生的生长因子(如PDGF)及OX-LDL等对单核细胞亦有趋化活性。迁入内皮下间隙的单核细胞被激活并分化成巨噬细胞。
OX-LDL、OX-Lp(a)可与巨噬细胞表面的清道夫受体结合而被摄取。这些受体对胆固醇无下调作用,因而被巨噬细胞摄取的脂质愈来愈多,直至形成泡沫细胞(foam cell)(图8-1)。
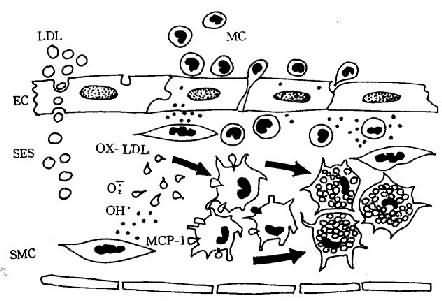
图8-1 单核细胞迁入内膜及泡沫细胞形成模式图
LDL渗入内皮下间隙(SES),被氧自由基氧化修饰;MCP-1释放,单核细胞(MC)迁入内膜,OX-LDL与巨噬细胞表面的清道夫受体结合而被摄取,泡沫细胞形成(EC:内皮细胞,SMC:平滑肌细胞)(仿Schwartz)
大量泡沫细胞聚集即形成脂纹,内皮隆起及变形。电镜下,巨噬细胞源性泡沫细胞表面富有突起,形成丝状伪足;胞浆内含有大量较小的脂质空泡和溶酶体,有时还见到胆固醇结晶;核卵圆或略呈肾形,异染色质常呈块状紧靠核膜,偶见1~2个核仁。内皮细胞、巨噬细胞及SMC均可分泌生长因子〔PDGF、纤维母细胞生长因子(FGF)、表皮生长因子(EGF)等〕,在其作用下,原已存在于内膜的SMC增生;中膜SMC发生表型转变(phenotypic modulation),即由收缩型(胞浆内含大量肌丝及致密体)转变为合成型(含大量粗面内质网、核蛋白体及线粒体);同时,SMC穿过内弹力板窗孔迁移入内皮下间隙并增生。SMC表面有LDL受体,可结合、摄取LDL及VLDL而成为泡沫细胞(肌源性泡沫细胞)。电镜下,肌源性泡沫细胞多呈长形,或有突起,多少保持SMC的特点,胞浆内可见肌丝和致密体,脂质空泡多少不定,一般稍大,有时能见到基底膜(图8-2)。
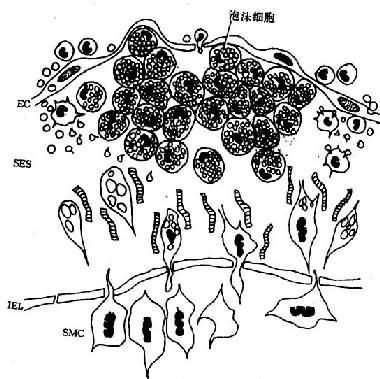
图8-2 脂纹组织结构模式图
内皮下间隙(SES)大量巨噬细胞源性泡沫细胞聚集,中膜SMC穿过内弹性膜(IEL)窗孔迁入内膜,增生并摄取脂质,内膜隆起及变形EC:内皮细胞病变的进展:已知OX-LDL具有细胞毒性,当大量OX-LDL被巨噬细胞摄取,超过了其清除能力时可引起泡沫细胞的坏死,导致细胞外脂质核心形成。加之,SMC大量增生,穿插于巨噬细胞源性泡沫细胞之间,产生胶原、弹性纤维及蛋白多糖,使病变演变为纤维斑块(图8-3)。
2.纤维斑块 肉眼观,纤维斑块(fibrous plaque)为隆起于内膜表面的灰黄色斑块。随着斑块表层的胶原纤维不断增加及玻璃样变,脂质被埋于深层,斑块乃逐渐变为瓷白色。镜检下,斑块表面为一层纤维帽,乃由多量SMC及大量细胞外基质(包括胶原、弹性纤维、蛋白聚糖及细胞外脂质)组成。纤维帽之下有不等量的增生的SMC、巨噬细胞及两种泡沫细胞,以及细胞外脂质及基质(图8-4,图8-5)。
由于OX-LDL的细胞毒性作用,以及很可能内皮细胞及SMC产生的氧自由基的作用,可引起斑块内细胞损伤及坏死。比较脆弱的巨噬细胞源性泡沫细胞坏死后,其胞浆内的脂质被释放出来,成为富含胆固醇酯的脂质池。泡沫细胞坏死崩解,释放出许多溶酶体酶,促进其它细胞坏死崩解。随着这些病理过程的发展,纤维斑块逐渐演变为粥样斑块。
3.粥样斑块 粥样斑块(atheromatous plaque)亦称粥瘤(atheroma)。肉眼观,为明显隆起于内膜表面的灰黄色斑块。切面,表层的纤维帽为瓷白色,深部为多量黄色粥糜样物质(由脂质和坏死崩解物质混合而成)(图8-6)。镜检下,纤维帽趋于老化,胶原纤维陷于玻璃样变,SMC被分散埋藏在细胞外基质之中。深部为大量无定形坏死物质,其内富含细胞外脂质,并见胆固醇结晶(石蜡切片上为针状空隙)、钙化等(图8-7)。底部和边缘可有肉芽组织增生,外周可见少许泡沫细胞和淋巴细胞浸润。病变严重者中膜SMC呈不同程度萎缩,中膜变薄。外膜可见新生毛细血管、不同程度的结缔组织增生及淋巴细胞、浆细胞浸润。一些学者认为,这种外膜炎症(慢性主动脉周围炎)可能是对粥瘤中的类蜡质(ceroid 一种含高度不饱和脂肪酸的黄色腊样物质)成分的一种自身免疫反应。
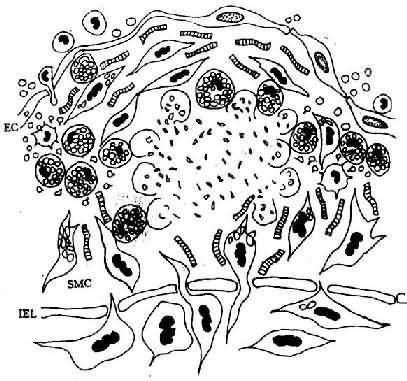
图8-3 脂纹的进展
泡沫细胞坏死及细胞外脂质核心形成,SMC继续增生,产生胶原、弹性纤维及蛋白多糖,使病变演变为纤维斑块

图8-4 发展中的纤维粥样斑块
斑块表层为脂纹,含有泡沫细胞和增生的平滑肌细胞;深层有大量胆固醇(针状结晶)析出和泡沫细胞散在。男性,25岁,主动脉。
(阜外医院病理科供图)
图8-5 发展中的纤维粥样斑块
图8-4的斑块深层。高倍镜下可见大量胆固醇结晶、泡沫细胞和增生的平滑肌细胞
 动脉粥样硬化"/>
动脉粥样硬化"/>
图8-6 主动脉粥样硬化
主动脉内膜面见粥样斑块形成
4.复合病变
(1)斑块内出血:在粥样斑块的边缘常见到许多薄壁的新生血管。在血流剪应力作用下,这些薄壁血管常易破裂出血,可形成血肿,使斑块更加隆起,其后血肿被机化。
(2)斑块破裂:为最危险的并发症,斑块破裂常形成溃疡(粥瘤性溃疡)及并发血栓形成;坏死性粥样物质可排入血流而造成胆固醇栓塞。斑块破裂常见于腹主动脉下端、髂动脉和股动脉。富含软的细胞外脂质的斑块,特别是脂质池偏位时,容易破裂。斑块外周部分纤维帽最薄,含胶原、氨基葡聚糖及SMC较少,细胞外脂质较多,抗张强度较差,该处巨噬细胞源性泡沫细胞浸润也最多。因此,破裂往往发生在纤维帽的外周。
(3)血栓形成:表浅的或由于斑块破裂造成较深的内膜损伤,均可使胶原暴露,通过von Willebrand因子的介导,引起血小板的聚集而形成血栓,可引起器官动脉阻塞而导致梗死(如脑梗死、心肌梗死)。冠状动脉血栓的机化及再通可在一定程度上恢复该支动脉的血流,有助于保持梗死灶周围心肌的存活。
(4)钙化:多见于老年患者,钙盐可沉积于坏死灶及纤维帽内,动脉壁因而变硬、变脆。钙化灶可进而发生骨化。
 动脉粥样硬化"/>
动脉粥样硬化"/>
图8-7 主动脉粥样硬化
内膜中形成粥瘤,其中为一些坏死物质及胆固醇结晶,表面内膜呈纤维性增厚
(5)动脉瘤形成:严重的粥样斑块底部的中膜SMC可发生不同程度的萎缩,以致逐渐不能承受血管内压力(张力)的作用而扩张,形成动脉瘤(aneurysm)。另外,血流可从粥瘤性溃疡处侵入主动脉中膜,或中膜内血管破裂出血,均可造成中膜撕裂,形成夹层动脉瘤(aneurysma dissecans)。
| 上一页:二、动脉粥样硬化发生机制学说 |
| 当前页:三、病理变化 |
| 下一页:四、重要器官的动脉粥样硬化 |