六、烯烃的亲电加成反应历程
(一)烯烃与卤素的加成
乙烯和溴的加成是亲电加成,加成过程如下:非极性的溴分子由于受乙烯π电子或极性条件(如微量的水、玻璃容器的器壁等)的影响而极化变成了偶极分子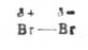
。加成反应分两步进行。第一步
中带正电荷的
Brσ+部分进攻乙烯分子,使C=C中的π键变弱,Br-Br中的σ键也变弱,生成一个带正电荷的σ络合物——环状溴鎓离子及Br-。
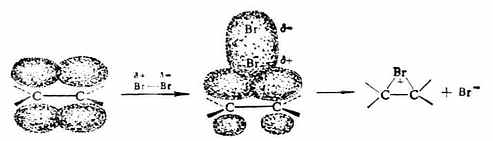
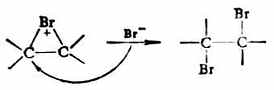
第二步Br-从溴鎓离子的背面进攻,得加成产物。
用实验方法可以证明是Brσ+而不是Brσ-首先与烯烃加成。
在乙烯与溴加成反应中,第一步进行得较慢,是决定反应速率的步骤。第二步是带相反电荷的两个离子间结合,所以反应较快。由于决定反应的一步是由亲电试剂发动进攻的,所以该反应是亲电反应。又由于整个反应是加成反应,故叫做亲电加成反应。
(二)烯烃与卤化氢的加成
烯烃与卤化氢(HCl,HBr,HI)或浓的氢卤酸的加成也是亲电加成。卤化氢是极性分子(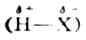
),氢卤酸为H+X-。
加成反应的第一步是质子(H+)与烯烃生成碳正离子。这是决定反应速率的一步。
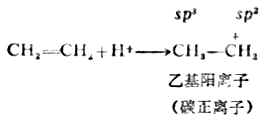
碳正离子中,带正电荷的碳是sp2杂化的,这个碳上有空的未参与杂化的p轨道。
第二步,X-与碳正离子结合,生成卤代烷
CH3CH2++X-→CH3CH3x
不对称烯烃(如丙烯)与HX的加成符合马氏规则。反应第一步生成的碳正离子有两种可能性:一种是(Ⅰ),即正电荷在中间一个碳原子(C-2)上;另一种是(Ⅱ),即正电荷在末端的碳原子(C-1)上。
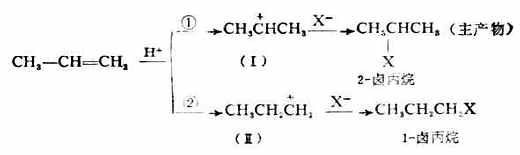
实验表明,生成这两种碳正离子(Ⅰ及Ⅱ)所需的活化能不同,生成(Ⅰ)的活化能较小,生成(Ⅱ)的活化能较大;同时,(Ⅰ)与(Ⅱ)本身的能量大小也不一样,(Ⅰ)较小而(Ⅱ)较大。所以各种烷基碳正离子的稳定性次序为:3°>2°>1°>+CH3。2°碳正离子要比1°碳正离子更容易生成。也就是说异丙基碳正离子(Ⅰ)比丙基碳正离子(Ⅱ)更容易生成。因此,(Ⅰ)是丙烯与HX加成反应的主要中间体,即第二步反应的主产物是2-卤丙烷而不是1-卤丙烷。
| 上一页: 五、烯烃的化学性质 |
| 当前页:六、烯烃的亲电加成反应历程 |
| 下一页:七、诱导效应 |