二、多元酸碱在溶液中的离解
多元酸碱在溶液中的离解是分步进行的,叫做分步离解。表2-2列出了一些常见的多元酸的分步离解常数。表中pKa为Ka的负对数值。
表2-2 一些常见的多元酸的分步离解常数
| 名称 | 分子式 | Ka1 | PKa1 | Ka2 | PKa2 | Ka3 | PKa3 |
|
| 酸性强度增加 | 草酸 | H2C2O4 | 5.4×10-2 | 1.27 | 5.4×10-5 | 4.27 | 2.2×10-13 | 12.67 |
| 亚硫酸 | H2SO3 | 1.54×10-2 | 1.81 | 1.02×10-7 | 6.91 | |||
| 磷酸 | H3PO4 | 7.52×10-3 | 2.12 | 6.23×10-8 | 7.21 | |||
| 丙二酸 | CH2(COOH)2 | 1.38×10-3 | 2.86 | 2×10-6 | 5.70 | |||
| 邻苯二甲酸 | C6H4(COOH)2 | 1.12×10-3 | 2.95 | 3.9×10-5 | 5.41 | |||
| 酒石酸 | (CHOHCOOH)2 | 9.1×10-4 | 3.04 | 4.3×10-5 | 4.37 | |||
| 碳酸 | H2CO3 | 4.30×10-7 | 6.37 | 5.61×10-11 | 10.25 | |||
| 氢硫酸 | H2S | 9.1×10-8 | 7.04 | 1.1×10-12 | 11.96 |
例如草酸(H2C2O4)的离解分两步进行。
一级离解
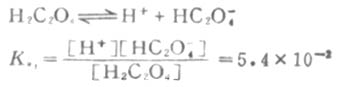
二级离解
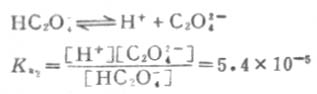
二级离解总比一级离解困难,因为H+要克服带有两个电荷的C2O2-4对它的吸引。从Ka1和Ka2可以反映这一点。草酸溶液中的HC2O-4浓度要比C2O2-4浓度大得多。
磷酸的离解要分三步,有Ka1、Ka2、和Ka3三个离解常数,且Ka1》Ka2》Ka3。这说明多元酸分级离解是依次变难。
根据多元酸的浓度和各级离解常数,可以算出溶液中各种离子的浓度。
例2 计算0.1mol·L-1H2S溶液中的H+和S2-的浓度。
解:由于H2S的 Ka1》Ka2 ,所以H2S溶液中的H+主要来自第一步离解,而第一步离解所产生的H+,又抑制第二步离解。这样计算H2S溶液中H+的总浓度时,可以忽略第二步离解的H+,近似地等于第一步离解平衡时H+浓度。
设第一步离解平衡时[H+]=x,则[H+]≈[HS-],平衡时则有下列关系:
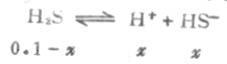
由表2-2知H2S的Ka为9.1×10-8,则
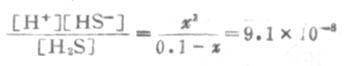
因Ka1很小,x必然很小,所以0.1-x≈0.1,则
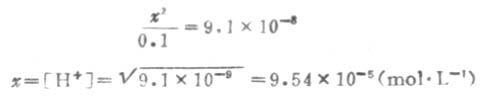
溶液中的S2-是第二步离解的产生,因此,计算溶液中的S2-浓度时,应根据第二步离解平衡进行计算.
设第二步离解时,[S2-]=y,平衡时有下列关系:
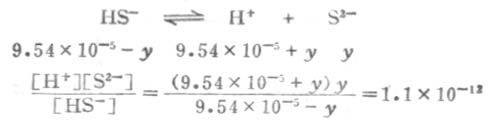
因为Ka1极小,y必然极小,所以9.54×10-5±y≈9.54×10-5,则
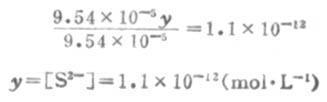
所以,[S2-]≈Ka2。
| 上一页:一、一元弱酸弱碱的离解平衡 |
| 当前页:二、多元酸碱在溶液中的离解 |
| 下一页:三、强电解质在溶液中的离解 |