三、羧酸的化学性质
羧酸是由羧基和烃基组成的,羧基包括羰基和羟基两个部分,因而不同程度地反映了羰基和羟基的某些性质。但羧基的性质并非两个基团的简单加和,由于羰基和羟基的相互影响表现出许多新的性质。
用物理方法测定甲酸中C=O键长为0.1245nm,比普通羰基的键长(0.122nm)略长一点;C-OH键中的碳氧键长为0.131nm,比醇中的键长(0.143nm)短得多。这表明羧酸中羰基与羟基间发生了相互影响。
在羧酸分子中,羰基碳原子的三个sp2杂化轨道一个与氧成键,一个与羟基氧成键,另一个与氢或烃基成键,这三个轨道在一个平面上,键角约120°;碳原子上的一个未参与杂化的p轨道与氧原子的p轨道构成了π键。但羧基中-OH氧上有一对未共用的电子,可与π键形成p-π共轭体系。
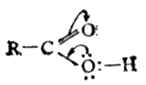
这样一来,一方面使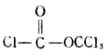
原子团失去了典型的羰基性质,另一方面-OH氧原子的电子云向羰基移动,氧的电子云密度降低,有利于氢的离解,故羧酸的酸性强于醇。
经X射对甲酸根离子的测定表明,它的两个碳氧键的键长都是0.127 nm 。这说明氢以质子形式脱离羧基后,p-π共轭作用更完全,发生了键的平均化。这样,-COO-上的负电荷不再集中于一个氧原子,而是平均分配在两个氧上,所以羧酸根离子更稳定.
根据羧酸的构造,它可以发生如下反应。
(一)酸性
羧酸在水中可离解出质子而显酸性,其pKa值一般为4-5,属于弱酸。
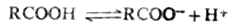
羧酸的酸性虽比盐酸,硫酸等无机酸弱得多,但比碳酸(pKa=6.35)和一般的酚类(pKa-10)强。故羧酸能分解碳酸盐和碳酸氢盐,放出二氧化碳。
2RCOOH+Na2CO3→2RCOONa+CO2↑+H2o
RCOOH+NaHCO3→RCOONa+CO2↑+H2o
利用羧酸与碳酸氢钠的反应可将羧酸与酚类相区别。因羧酸可溶于碳酸氢钠溶液并放出二氧化碳,而一般酚类与碳酸氢钠不起作用。
低级和中级羧酸的钾盐、钠盐及铵盐溶于水,故一些含羧基的的药物制成羧酸盐以增加其在水中的溶解度,便于做成水剂或注射剂使用,。
在羧酸(RCOOH)分子中,与羧基直接或间接直连的原子团对羧酸的酸性有不同程度的影响(表16-3)。
表16-3 一些羧酸的电离常数
| 化合物 | 构造式 | PKa |
| 1.甲酸 | HCOOH | 3.77 |
| 2.乙酸 | CH3COOH | 4.76 |
| 3.氯乙酸 | ClCH2COOH | 2.86 |
| 4.二氯乙酸 | Cl2CHCOOH | 1.29 |
| 5.三氯乙酸 | Cl3CCOOH | 0.65 |
| 6.溴乙酸 | BrCH2COOH | 2.90 |
| 7.碘乙酸 | ICH2COOH | 3.18 |
| 8.氟乙酸 | FCH2COOH | 2.66 |
| 9.三氟乙酸 | F3CCOOH | 强酸 |
| 10.丁酸 | CH3CH2CH2COOH | 4.82 |
| 11.α-氯丁酸 | 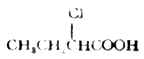 | 2.84 |
| 12.β-氯丁酸 | 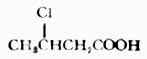 | 4.06 |
| 13.γ-氯丁酸 | CLCH2CH2CH2COOH | 4.52 |
和脂肪酸中,与羧基相连的烷基具有供电诱导效应(+I),使羧基上的氢较难离解,酸性较甲酸弱(表16-3中的1,2)。当卤素取代羧酸分子中烃基上的氢后,由于卤原子的吸电子诱导效应(-I),酸性增强(表16-3中的3,6,7,8)。烃基某个碳上引入的卤原子的数目越多,酸性越强(表16-3中的3,4,5及8,9)当卤原子相同时,卤原子距羧基越近,酸性越强(表16-3中的11,12,13)。当卤原子的种类不同时,它们对酸性的影响是F>CL>Br>I。所以氟乙酸的酸性>氯乙酸>溴乙酸>碘乙酸(表16-3中的3,6,7,8)。
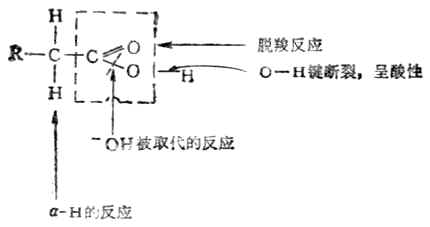
(二)羟基被取代的反应
羧酸中的羟基可以被其它原子或原子团取代,生成羧酸衍生物。例如:
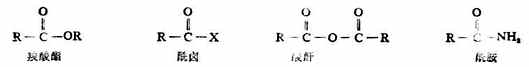
羧酸分子中去掉羧基上的羟 基后,余下的原子团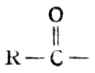
叫做酰基。
1.酯化反应
酸与醇脱水生成酯的反应叫做酯 化。
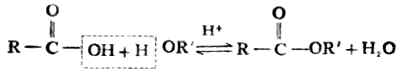
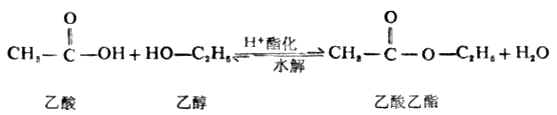
羧酸与醇的酯化反应是可逆的,而且反应速率很慢,需用酸作催化剂。例如:
2.酰卤的生成
羧酸(除甲酸外)能与三卤化磷、五卤化磷或亚硫酰氯(SOCL2)反应,羧基中的羟基被卤素取代生成相应的酰卤。
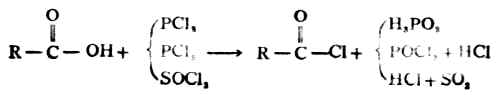
例如:
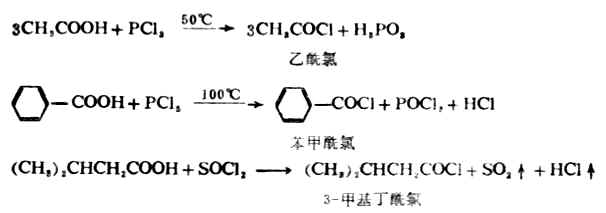
应用SOCL2制备酰卤时,副产物都是气体,便于处理及提纯。
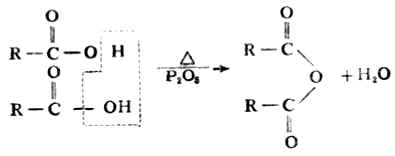
3.酸酐的生成
除甲酸外,一元羧酸与脱水剂共热时,两分子羧酸可脱去一分子水,生成酸酐。
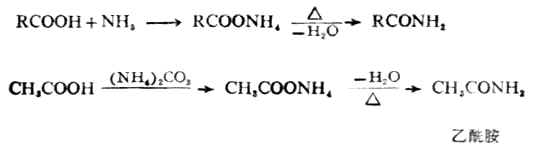
4.酰胺的生成
在羧酸中通入氨气或加入碳酸铵,可以得到羧酸的铵盐。将固体的羧酸铵加热,分子内失去一分子水生成酰胺。
(三)脱羧反应和二元羧酸的受热反应
羧酸脱去羧基的反应叫做脱羧。这个反应的结果是从羧基脱去CO2。
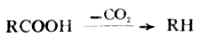
除甲酸外,一元羧酸较稳定,直接加热时难以脱羧,只有在特殊条件下才可发生,生成少一个碳的烃。例如:
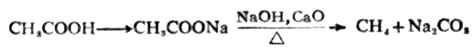
生物体内发生的许多重要的脱羧反应是在脱羧酶的作用下进行的。
有些二元酸对热不稳定,在加热或与脱水剂共热的条件下,随两个羧基间距不同而发生脱羧反应或脱水反应,这是二元羧酸的特性。
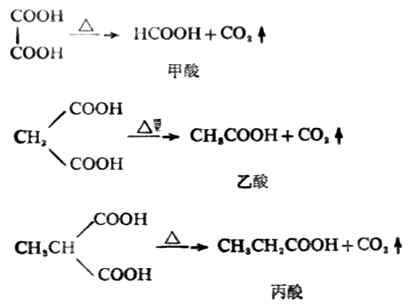
1.乙二酸和丙二酸
乙二酸或丙二酸加热脱羧生成一元羧酸。
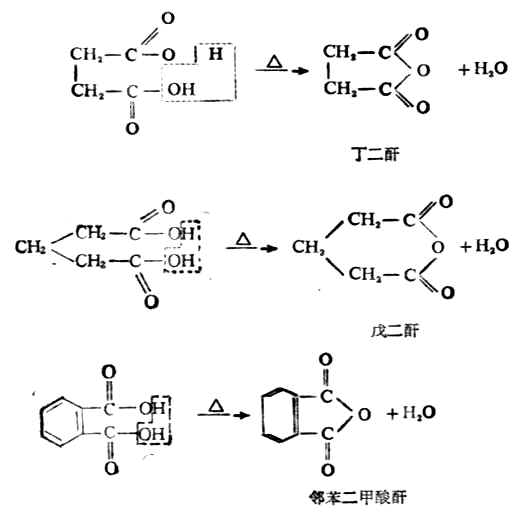
2.丁二酸、戊二酸及邻苯二甲酸
这三种酸与脱水剂共热时失水,生成环状酸酐。
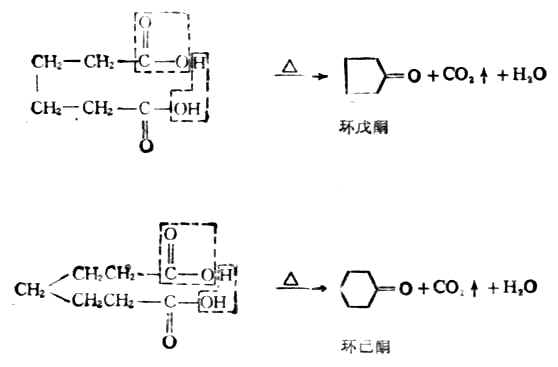
3.己二酸,庚二酸
己二酸、庚二酸与氢氧化钡共热时,既失水又脱羧 ,生成环酮。
(四)α-H的卤代作用
与羰基相似,羧基也能活化α-H,但其致活作用比羰基小得多。因此,羧酸中的α-H被卤素取代的反应较慢,需加入红磷、硫或碘等作催化剂或在光照下才易进行。
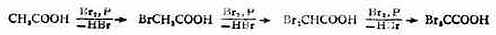
| 上一页:二、羧酸的物理性质 |
| 当前页:三、羧酸的化学性质 |
| 下一页:四、重要的羧酸 |