二、溶液的PH值
在纯水或中性溶液中,25℃时
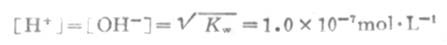
当向水中加入酸时,溶液中[H+]就会增大,设达到新的平衡时该溶液的[H+]为1.0×10-2mol·L-1,因[H+][OH-]=1.0×10-14,则
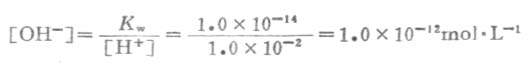
可见,在酸性溶液中,[H+]>1.0×10-7 mol·L-1,而[OH-]<1.0×10-7 mol·L-1.
如果向纯水中加入碱时,溶液中[OH-]就会增大,设达到新的平衡时该溶液的[OH-]为1.0×10-2mol·L-1,同理计算出[H+]=1.0×10-12 mol·L-1。可见,在碱性溶液中[OH-]>1.0×10-7mol·L-1,而[H+]<1.0×10-7 mol·L-1。由上述三种情况可知:
在纯水或中性溶液中 [H+]=1.0×10-7 mol·L-1=[OH-]
在酸性溶液中[H+]>1.0×10-7mol·L-1>[OH-]
在碱性溶液中[H+]<1.0×10-7mol·L-1<[OH-]
当然,[H+]或[OH-]都可用来表示溶液中的中性、酸性或碱性,但实际应用中多采用[H+]来表示。但是,在生物学与医学上许多重要溶液的[H+]往往是一个很小的数值,而且带有负指数,用[H+]表示溶液的酸碱性不方便。例如,人的血液[H+]为0.0000000398mol·L-1,即3.98×10-8 mol·L-1,血液究竟是酸性还是碱性,不容易看清楚。索仑生(Sorensen)首先提出用PH值表示水溶液的酸碱性。
溶液的PH值是氢离子浓度的负对数值。
它的数学表示式为:pH=-lg[H+]
即 [H+]=10-pH(3-3)严格地说,考虑活度时:
Pα+=lgαH+ (3-4)
必须注意,PH值每相差一个单位时,其[H+]相差10倍;PH值相差二个单位时,[H+]相差100倍;依此类推。
用PH值表示稀的水溶液的酸碱性,则有“
在纯水或中性溶液中, [H+]=1.0×10-7 mol·L-1 PH=7
在酸性溶液中, [H+]>1.0×10-7mol·L-1 PH<7 ,PH越小,则酸性越强。
在碱性溶液中, [H+]<1.0×10-7 mol·L-1 PH>7,PH越大,则碱性越强。
和PH相仿,[OH-]和KW也可用它们的负对数来表示,即
pOH=-lg[OH-] (3-5)
pKw=-lgKw (3-6)
由于在25℃时,[H+][OH-]=KW=1.0×10-14
将方程两边取负对数,则得
-lg[H+]-lg[OH-]=-lgKw=-lg1.0*10-14
所以
pH+pOH=pKw=14 (3-7)
水溶液中[H+],[OH-],PH,POH值与溶液酸碱性的关系如表3-2。
表3-2 [H+],[OH-],PH,POH值与溶液酸碱性的关系
| [H+] | 100 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 | 10-14 |
| PH | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 的酸 碱性 | 中酸性逐渐增强性 碱性逐渐增强 | ||||||||||||||
| POH | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 0 |
| [OH-] | 10-14 | 10-13 | 10-12 | 10-11 | 10-10 | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | 100 |
在实际应用中,PH值一般只限于0-14范围内。当 [H+]或[OH-]大于(即100)时,就不再采用PH值,而仍用[H+]或[OH-]表示溶液的酸碱性。
必须注意,用PH值表示的是溶液的酸度或有效酸度而不是酸的浓度。酸度或有效酸度是指溶液中H+浓度,严格地说是指H+的活度,是指已离解部分酸的浓度。酸的浓度也称总酸度或分析浓度,它是指在1升溶液中所含酸的物质的量,包括已离解和未离解两部分酸的总浓度,其大小要用滴定分析来确定。酸度或有效酸度则用PH试纸或PH计来测定。潜在酸度是指未离解部分的浓度,即总酸度与有效酸度之差。例如,0.01mol·L-1HCL和0.01 mol·L-1HOAc的浓度相同,但有效酸度不同。0.01 mol·L-1HCL溶液总酸度为0.01mol·L-1,其有效酸度[H+]也是相同数值,25℃时,总酸度为0.01mol·L-1的HOAc溶液,其有效酸度[H+]则仅为4.2×10-4mol·L-1。
例1 分别求出0.1mol.L-1 HCl溶液和0.01mol.L-1 HOAc溶液的pH值,已知其[H+]分别为0.01mol.L-1和4.2*10-4mol.L-1。
解:HCl溶液的pH=-lg0.01=-lg10-2=2.0
HOAc溶液的pH=-lg(4.2*10-4)
=[0.62+(-4)]
=3.38
例2 已知某溶液的pH=4.60,计算该溶液的氢离子浓度。
解:-lg[H+]=pH=4.60
lg[H+]=4.60=-5+0.40=5.40
查0.4的反数为2.512,故
[H+]=2.512*10-5mol.L-1
| 上一页:一、水的离子积 |
| 当前页:二、溶液的PH值 |
| 下一页:三、PH值在医学上的应用 |