二、含硫氨基酸的代谢
含硫氨基酸共有蛋氨酸、半胱氨酸和胱氨酸三种,蛋氨酸可转变为半胱氨酸和胱氨酸,后两者也可以互变,但后者不能变成蛋氨酸,所以蛋氨酸是必需氨基酸。
(一)蛋氨酸代谢
1.转甲基作用与蛋氨酸循环 蛋氨酸中含有S甲基,可参与多种转甲基的反应生成多种含甲基的生理活性物质。在腺苷转移酶催化下与ATP反应生成S-腺苷蛋氨酸(S-adenosglmethiomine,SAM)。SAM中的甲基是高度活化的,称活性甲基,SAM称为活性蛋氨酸。
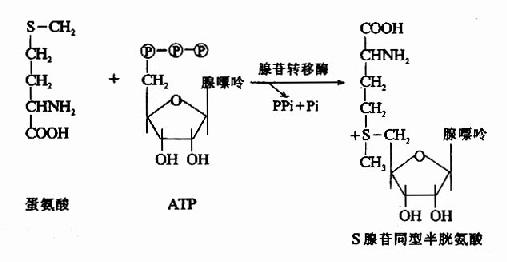
SAM可在不同甲基转移酶(methyl transferase)的催化下,将甲基转移给各种甲接受体而形成许多甲基化合物,如肾上腺素、胆碱、甜菜碱、肉毒碱、肌酸等都是从SAM中获得甲基的。SAM是体内最主要的甲基供体。
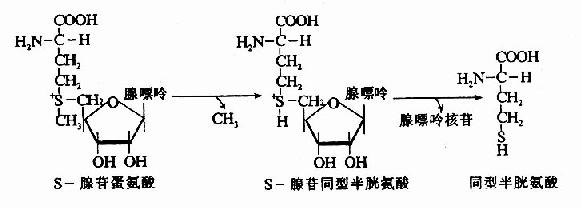
SAM转出甲基后形成S腺苷同型半胱氨酸Sadenosylhomocystine,SAH),SAH水解释出腺苷变为同型半胱氨酸(homocystine,hCys)。同型半胱氨酸可以接受N5桟H3桯F4提供的甲基再生成蛋氨酸,形成一个循环过程,称为蛋氨酸循环(methionine cycle)。此循环的生理意义在于蛋氨酸分子中甲基可间接通过N5桟H3桭H4由其它非必需氨基酸提供,以防蛋氨酸的大量消耗(图7-15)。
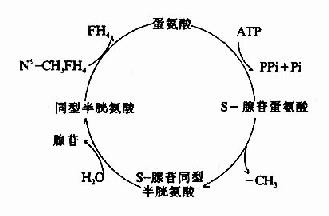
图7-15 S-腺苷蛋氨酸循环
N5-CH3FH4同型半胱氨酸甲基转移酶的辅酶是甲基B12。维生素B12缺乏会引起蛋氨酸循环受阻。临床上可以见到维生素B12缺乏引起的巨幼细胞性贫血。1962年Noronha与Silverman首先提出了甲基陷阱学说(methyl-trap hypothesis),后来Herbert与Zaulsky又作了修改。这个学说认为:由于维生素B12缺乏,引起甲基B12缺乏,使甲基转移酶活性低下,甲基转移反应受阻导致叶酸以N5-CH3FH4形式在体内堆积。这样,其它形式的叶酸大量消耗,以这些叶酸作辅酶的酶活力降低,影响了嘌呤碱和胸腺嘧啶的合成,因而影响核酸的合成,引起巨幼细胞性贫血。也就是说,维生素B12对核酸合成的影响是间接地通过影响叶酸代谢而实现的。
虽蛋氨酸循环可生成蛋氨酸,但体内不能合成同型半胱氨酸,只能由蛋氨酸转变而来,所以体内实际上不能合成蛋氨酸,必须由食物供给。
同型半胱氨酸还可在胱硫醚合成酶(cystathiorinesynthase)催化下与丝氨酸缩合生成胱硫醚(cystathionine),再经胱硫醚酶催化水解生成半胱氨酸,α-酮丁酸和氨。α-酮丁酸转变为琥珀酸单酰CoA,通过三羧酸循环,可以生成葡萄糖、所以蛋氨酸为生糖氨基酸。
2.肌酸的合成 肌酸(creatine)和磷酸肌酸(creatinephosphate)在能量储存及利用中起重要作用。二者互变使体内ATP供应具有后备潜力。肌酸在肝和肾中合成,广泛分布于骨骼肌、心肌、大脑等组织中。肌酸以甘氨酸为骨架,精氨酸提供脒基、SAM供给甲基、在脒基转移酶和甲基转移酶的催化下合成。在肌酸激酶(creatinephosphohinase,CPK)催化下将ATP中桺转移到肌酸分子中形成磷酸肌酸(CP)储备起来(图7-16)。
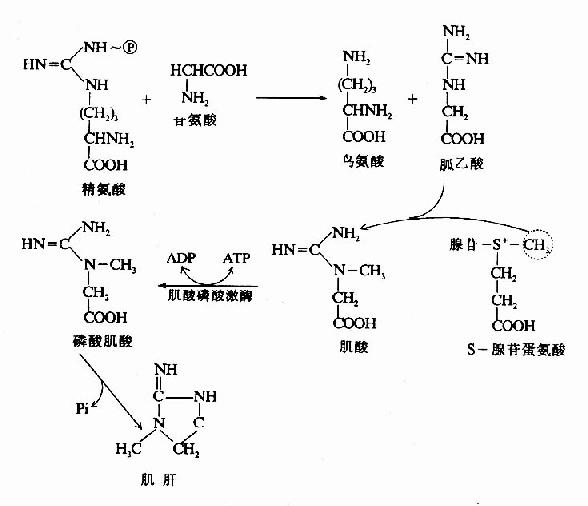
图7-16 肌酸的代谢
CPK由两种亚基组成;即M亚基(肌型)与B亚基(脑型)。有三种同工酶;即MM型(在骨骼肌中)BB型在脑中)和MB型(在心肌中)。心肌梗塞时,血中MB型CPK活性增高,可作辅助诊断的指标之一。
肌酸和磷酸肌酸代谢的终产物是肌酸酐(creatinine)简称肌酐。正常成人,每日尿中肌酐量恒定。肾功能障碍时,检查血或尿中肌酐含量以帮助诊断。
(二)半胱氨酸和胱氨酸的代谢
1.半胱氨酸和胱氨酸的互变 半胱氨酸含巯基(-SH),胱氨酸含有二硫键(S-S-),二者可通过氧化还原而互变。胱氨酸不参与蛋白质的合成,蛋白质中的胱氨酸由半胱氨酸残基氧化脱氢而来。在蛋白质分子中两个半胱氨酸残基间所形成的二硫键对维持蛋白质分子构象起重要作用。而蛋白分子中半胱氨酸的巯基是许多蛋白质或酶的活性基团。
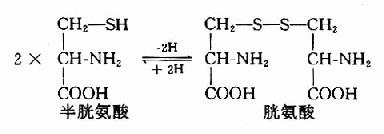
2.半胱氨酸分解代谢 人体中半胱氨酸主要通过两条途径降解为丙酮酸。一是加双氧酶催化的直接氧化途径,或称半胱亚磺酸途径,另一是通过转氨的3-巯基丙酮酸途径。
3.活性硫酸根代谢 含硫氨基酸经分解代谢可生成H2S,H2S氧化成为硫酸。半胱氨酸巯基亦可先氧化生成亚磺基,然后再生成硫酸。其中一部分以无机盐形式从尿中排出,一部分经活化生成3′磷酸腺苷-5'-磷酸硫酸(3'-phosphoadenosine5'-phosphosulfate,PAPS),即活性硫酸根。
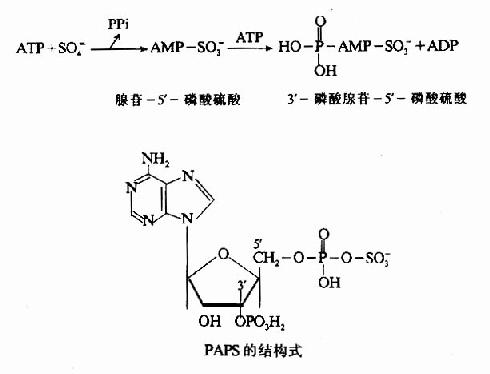
PAPS的性质活泼,在肝脏的生物转化中有重要作用。例如类固醇激素可与PAPS结合成硫酸酯而被灭活,一些外源性酚类亦可形成硫酸酯而增加其溶解性以利于从尿于排出。此外,PAPS也可参与硫酸角质素及硫酸软骨素等分子中硫酸化氨基多糖的合成。
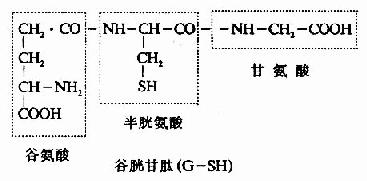
4.谷胱甘肽的合成 谷胱甘肽(glutathiose,rglutamylcysteinglglycine,GSH)是一种含γ-酰胺键的三肽,由谷氨酸、半胱氨酸及甘氨酸组成。GSH的合成通过γ-谷氨酰基循环(γ-glutamyl cycle),由Meister提出,又称为Meister循环(图7-17)。γ-谷氨酰基循环有双重作用,一是GSH的再合成,二是通过GSH的合成与分解将外源氨基酸主动转运到细胞内。

图7-17 γ-谷氨酰基循环
GSH的合成由γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteinsynthetase)和GSH合成酶(GSHsynthetase)所催化。由ATP水解供能。GSH的分解中γ-谷氨酰转肽酶(γ-glutamyl transpeptidase)、γ-谷氨酰环转移酶(γ-gltamyl cyclotransforase)和5氧脯氨酸酶(5oxoprolinase)及一个细胞内肽酶(protease)所催化。
GSH在人体解毒、氨基酸转运及代谢中均有重要作用。GSH的活性基团是其半胱氨酸残基上的巯基,GSH有氧化型和还原型两种形式,可以互变。
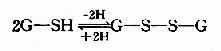
谷胱甘胱还原酶催化上面反应,辅酶为NADPH,细胞中GSH与GSSG的比例为100:1。GSH可保护某些蛋白质及酶分子的巯基不被氧化,从而维持其生物活性。如红细胞中含有较多GSH,对保护红细胞膜完整性及促使高铁血红蛋白还原为血红蛋白均有重要作用。此外,体内产生的过氧化物及自由基,亦可通过含硒的GSH过氧化酶而被清除,如:

| 上一页:一、一碳单位代谢 |
| 当前页:二、含硫氨基酸的代谢 |
| 下一页:三、芳香族氨基酸的代谢 |