分子间同时存在着引力和斥力,它们的大小都跟分子间的距离有关.分子间的相互作用起源于电磁力.每个组成分子的原子都有分别带正、负电的原子核和核外电子,以呈电中性的单原子分子为例,它的核外电子的总负电量与原子核的正电量不仅大小相等,而且当保持它们的正常位置不变时,它们的正、负电荷对外的总作用效果为零.如果两分子相互靠近到一定程度时,每个分子中的电荷分布都要稍微离开正常位置,导致出现分子间的相互作用.这时分子力一部分是由于带电粒子间的静电力,在异种电荷间的平均距离小于同种电荷间的平均距离的情况下,分子间主要表现为吸引力:另外还决定于电子在运动过程中某些特定的相互联系(如运动情况完全相似的电子具有互相回避的倾向),当两分子靠得非常近,以致它们的外层电子云开始重叠起来时,分子间主要表现为排斥力.这些诸多因素综合起作用的结果,形成了分子间作用力的吸引、排斥性质的不同以及大小等均随距离变化的较为复杂的表现.
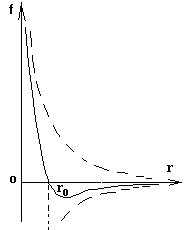
对于比较复杂的分子间相互作用情况,为处理问题方便,可采用一些简化模型作近似描述.如图所示分子力跟距离的关系,是其中一种理想模型.图中两条虚线分别表示两分子间同时存在的引力和斥力随距离变化的情形,实线表示它们的合力即实际表现出来的分子间的作用力随距离变化的情形.图示引力和斥力都随距离的增大而减小、随距离的减小而增大,但斥力比引力随距离变化得快.当两分子间距离等于![]() 时,引力与斥力平衡,分子力为零,分子处于平衡位置.
时,引力与斥力平衡,分子力为零,分子处于平衡位置.![]() 的数量级约为10-10m.显然,当分子间距离
的数量级约为10-10m.显然,当分子间距离![]() 时,分子力表现为斥力;当
时,分子力表现为斥力;当![]() 时,分子力表现为引力.除r值稍大于
时,分子力表现为引力.除r值稍大于![]() 的一小段范围外,一般来说,表现为引力的分子力随着距离的增大而迅速减少,当分子间的距离的数量级大于10-9m时,已经变得十分微弱,可以忽略不计了.
的一小段范围外,一般来说,表现为引力的分子力随着距离的增大而迅速减少,当分子间的距离的数量级大于10-9m时,已经变得十分微弱,可以忽略不计了.