理想气体的分子之间除碰撞接触外没有相互作用,不存在分子势能.因此理想气体的内能就是气体系统所有分子热运动的动能总和.由于分子热运动的动能跟气体温度有关,分子势能跟气体体积有关.既然理想气体中不存在分子势能,因此它的内能只跟温度有关,跟体积无关.
跟任何物质系统一样,一定质量的理想气体,它的内能的变化同样遵循热力学第一定律![]() .下面以等压、等容、等温和绝热等过程为例,分析一定质量的理想气体在状态变化过程中的内能变化情况.
.下面以等压、等容、等温和绝热等过程为例,分析一定质量的理想气体在状态变化过程中的内能变化情况.
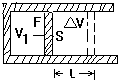
等压过程:保持气体压强不变,对一定质量的理想气体缓慢加热,使它由初始状态Ⅰ变到末状态Ⅱ,温度由![]() 升高到
升高到![]() ,根据气态方程,气体的体积将由
,根据气态方程,气体的体积将由![]() 增大到
增大到![]() ,过程中,由于温度
,过程中,由于温度![]() ,说明气体内能增加,
,说明气体内能增加,![]() ;同时体积
;同时体积![]() ,说明气体膨胀对外界做功,对于等压膨胀过程来说,气体对外界所做的功应等于
,说明气体膨胀对外界做功,对于等压膨胀过程来说,气体对外界所做的功应等于![]() =P·△V根据克拉珀龙方程
=P·△V根据克拉珀龙方程
![]() 象表示这一做功过程,如图(1)所示.其中,P-V线下的面积值表示的就是气体对外界所做的功.
象表示这一做功过程,如图(1)所示.其中,P-V线下的面积值表示的就是气体对外界所做的功.
根据热力学第一定律![]() ,上述过程中气体从外界吸热,Q>0;而气体膨胀对外做功,W<0.由于气体温度升高,
,上述过程中气体从外界吸热,Q>0;而气体膨胀对外做功,W<0.由于气体温度升高,![]() ,因此,过程中气体所吸热量Q必大于│W│.这说明,在等压膨胀过程中,一定质量的理想气体从外界吸收的热量,一部分用来增加气体的内能,另一部分则用来对外界做功.
,因此,过程中气体所吸热量Q必大于│W│.这说明,在等压膨胀过程中,一定质量的理想气体从外界吸收的热量,一部分用来增加气体的内能,另一部分则用来对外界做功.
等容过程:保持气体体积不变,对一定质量的理想气体缓慢加热,使它由初始状态Ⅰ变到末状态Ⅱ,温度由![]() 升高到
升高到![]() ,根据气态方程,气体的压强将由
,根据气态方程,气体的压强将由![]() 增大到
增大到![]() .在这一过程中,由于温度
.在这一过程中,由于温度![]() ,说明气体内能增加,
,说明气体内能增加,![]() .但过程中体积没有改变,没有做功问题,W=0.
.但过程中体积没有改变,没有做功问题,W=0.
根据热力学第一定律![]() ,上述过程中应有
,上述过程中应有![]() .这说明,在等容升温过程中,一定质量的理想气体从外界吸收的热量,全部用来增加气体的内能.
.这说明,在等容升温过程中,一定质量的理想气体从外界吸收的热量,全部用来增加气体的内能.
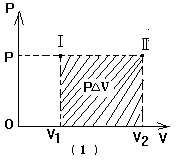
等温过程:保持气体温度不变,使一定质量的理想气体缓慢膨胀,使它由初始状态Ⅰ变到末状态Ⅱ,体积由![]() 增大到
增大到![]() ,根据气态方程,气体的压强将由
,根据气态方程,气体的压强将由![]() 减小到
减小到![]() .在这一过程中,由于温度保持不变,说明气体的内能也不改变,
.在这一过程中,由于温度保持不变,说明气体的内能也不改变,![]() .但过程中体积膨胀
.但过程中体积膨胀![]() ,说明气体对外做功(跟等压膨胀过程相比,这是气体压强不断变化的做功过程).经论证可知(由于所用数学知识超出中学范围,论证从略),这一做功过程也可用P-V图象表示,如图(2)所示.其中P-V线下的面积值表示的就是气体对外界所做的功.
,说明气体对外做功(跟等压膨胀过程相比,这是气体压强不断变化的做功过程).经论证可知(由于所用数学知识超出中学范围,论证从略),这一做功过程也可用P-V图象表示,如图(2)所示.其中P-V线下的面积值表示的就是气体对外界所做的功.
根据热力学第一定律![]() ,上述过程中,既然气体对外界做功,W<0,而且气体内能的变化
,上述过程中,既然气体对外界做功,W<0,而且气体内能的变化![]() ,则应有Q>0即吸热现象,而且Q与W的绝对值相等.这说明,在等温膨胀过程中,一定质量的理想气体要从外界吸收热量,所吸热量并没有增加气体的内能,而全部用来对外做功.
,则应有Q>0即吸热现象,而且Q与W的绝对值相等.这说明,在等温膨胀过程中,一定质量的理想气体要从外界吸收热量,所吸热量并没有增加气体的内能,而全部用来对外做功.
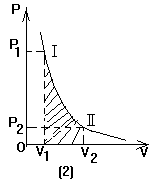
绝热过程:如果一定质量的理想气体由良好的绝热材料与外界隔绝,在状态变化过程中跟外界没有热交换,Q=0.根据热力学第一定律![]() ,由于Q=0,所以在绝热过程中应有
,由于Q=0,所以在绝热过程中应有![]() ,即在绝热压缩的过程中,外界对气体所做的功完全用来增加气体的内能,使气体的温度升高;而在绝热膨胀的过程中,则气体对外界所做功完全靠气体内能的减少,因此气体的温度降低.气体绝热做功过程同样可以用P-V图象表示,如图(3)所示.跟前面讨论的情况相似,还是用相应过程的P-V线~绝热线Ⅰ~下的面积值表示气体对外所做的功.为了供对比用,在图中还画出了相等质量同种气体的等温P-V线Ⅱ.两条图线的交点A表示同一状态.如果气体由状态A起分别经绝热过程和等温过程膨胀增加同样的体积,由于气体在绝热膨胀对外做功过程中内能减少,温度将降低,气体压强也将低于等温过程.
,即在绝热压缩的过程中,外界对气体所做的功完全用来增加气体的内能,使气体的温度升高;而在绝热膨胀的过程中,则气体对外界所做功完全靠气体内能的减少,因此气体的温度降低.气体绝热做功过程同样可以用P-V图象表示,如图(3)所示.跟前面讨论的情况相似,还是用相应过程的P-V线~绝热线Ⅰ~下的面积值表示气体对外所做的功.为了供对比用,在图中还画出了相等质量同种气体的等温P-V线Ⅱ.两条图线的交点A表示同一状态.如果气体由状态A起分别经绝热过程和等温过程膨胀增加同样的体积,由于气体在绝热膨胀对外做功过程中内能减少,温度将降低,气体压强也将低于等温过程.
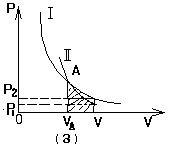
如图,气缺内一定质量的理想气体等压膨胀对外做功时,压强为P的气体对面积为S的活塞的推力F=PS,使活塞缓慢移动距离Lm,则气体对外界所做的功应等于![]()