体在宏观上处于平衡态时,虽然单个分子的速率都不相同,并且由于相互碰撞而不断发生变化,但平均说来,速率在某一范围内的分子数占有总分子数的百分比总是一定的,这个比值只与气体的种类及温度有关.英国物理学家麦克斯韦于1859年应用统计概念首先导出:气体处于平衡时,气体分子的数目按速率分布的规律.
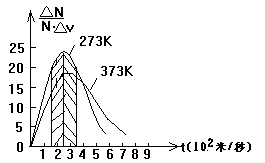
按照麦克斯韦的分子速率分布函数,对氧气在0℃和100℃时分子速率的分布情况画出分布函数曲线,如图所示.
从图中可看到,在0℃时速率在300~400m/s这一速率区间的分子数最多,占有总分子数的21.4%;速率大于400m/s和小于300m/s的分子数依次递减,速率很大的(900m/s以上的只占有0.9%)和很小的(100m/s以下的只占1.4%)分子都很少.形成“中间多,两头少”的统计分布规律.温度升高到100℃时,虽然这种分布规律不变,但与分子数所占比例最大值(18.6%)相对应的速率区间却移向速率大的一方,出现在400~500m/s区间.这说明,温度升高时,速率小的分子数减少(如100m/s以下的由1.1%降为0.7%),而速率大的分子数增多(如900m/s以上的由0.9%增为3.9%).显然,这种分子速率的分布规律是一种统计规律.上述的各速率区间的相对
![]()
种类固定不变,在同一温度下就会有确定的分子速率分布.
既然在一定温度下,某种气体的分子速率分布是确定的,就可以求出在这个温度下这种气体分子的平均速率,即所有分子的速率的平均值.从麦克
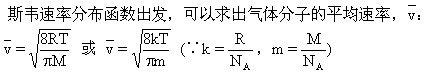
或中R是摩尔气体恒量,M是某种气体的摩尔质量;k是玻尔兹曼常数,
![]()
于温度升高时,速率大的分子数增加,因而分子的平均速率增大.