一、氨基酸的脱氨基作用
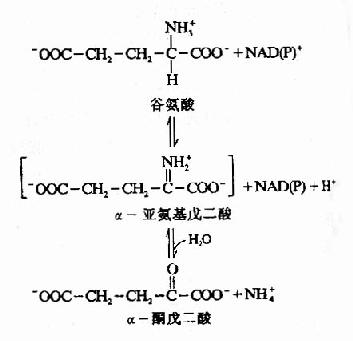
图7-2 谷氨酸脱氢酶催化的氧化脱氢反应
脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α酮酸的过程。这是氨基酸在体内分解的主要方式。参与人体蛋白质合成的氨基酸共有20种,它们的结构不同,脱氨基的方式也不同,主要有氧化脱氨、转氨、联合脱氨和非氧化脱氨等,以联合脱氨基最为重要。
(一)氧化脱氨基作用(Oxidative Deamination)
氧化脱氨基作用是指在酶的催化下氨基酸在氧化脱氢的同时脱去氨基的过程。
不需氧脱氢酶催化的氧化脱氨基作用
谷氨酸在线粒体中由谷氨酸脱氢酶(glutamatedehydrogonase)催化氧化脱氨。谷氨酸脱氢酶系不需氧脱氢酶,以NAD+或NADP+作为辅酶。氧化反应通过谷氨酸Cα脱氢转给NAD(P)+形成α亚氨基戊二酸,再水解生成α酮戊二酸和氨(图7-2)。
谷氨酸脱氢酶为变构酶。GDP和ADP为变构激活剂,ATP和GTP为变构抑制剂。
在体内,谷氨酸脱氢酶催化可逆反应。一般情况下偏向于谷氨酸的合成(△G°′≈30kJ·mal1),因为高浓度氨对机体有害,此反应平衡点有助于保持较低的氨浓度。但当谷氨酸浓度高而NH3浓度低时,则有利于脱氨和α酮戊二酸的生成。
(二)转氨基作用
转氨基作用(Transamination)指在转氨酶催化下将α-氨基酸的氨基转给另一个α-是酮酸,生成相应的α酮酸和一种新的α-氨基酸的过程。
体内绝大多数氨基酸通过转氨基作用脱氨。参与蛋白质合成的20种α-氨基酸中,除甘氨酸、赖氨酸、苏氨酸和脯氨酸不参加转氨基作用,其余均可由特异的转氨酶催化参加转氨基作用。转氨基作用最重要的氨基受体是α酮戊二酸,产生谷氨酸作为新生成氨基酸:

进一步将谷氨酸中的氨基转给草酰乙酸,生成α酮戊二酸和天冬氨酸:

或转给丙酮酸。生成α酮戊二酸和丙氨酸,通过第二次转氨反应,再生出α酮戊二酸。
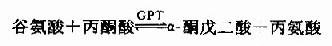
因而体内有较强的谷草转氨酸(glutamicpyruvic transaminase,GPT)和谷丙转氨酸(glutamic oxaloacetictrans aminase,GOT)活性。
转氨基作用是可逆的,该反应中△G°′≈0,所以平衡常数约为1。反应的方向取绝于四种反应物的相对浓度。因而,转氨基作用也是体内某些氨基酸(非必需氨基酸)合成的重要途径。
2.转氨基作用机理:
转氨基作用过程可分为两个阶段:
(1)一个氨基酸的氨基转到酶分子上,产生相应的酮酸和氨基化酶:
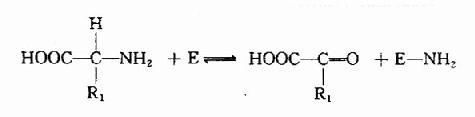
(2)NH2转给另一种酮酸,(如α酮戊二酸)生成氨基酸,并释放出酶分子:
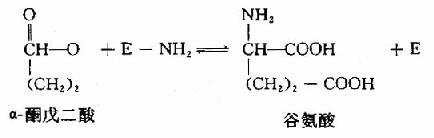
为传送NH2基因,转氨酶需其含醛基的辅酶-磷酸吡哆醛(pyridoxal-5′-phosphate,PLP)的参与。在转氨基过程中,辅酶PLP转变为磷酸吡哆胺(pyridoxamine5′phosphate,PMP)。PLP通过其醛基与酶分子中赖氨酸ω氨基缩合形成Schiff碱而共价结合子酶分子中。
Esmond Snell,Alexande Branstein和David Metgler等揭示转氨作用是一种兵乓机制,二阶段各分三步进行(图7-3)。
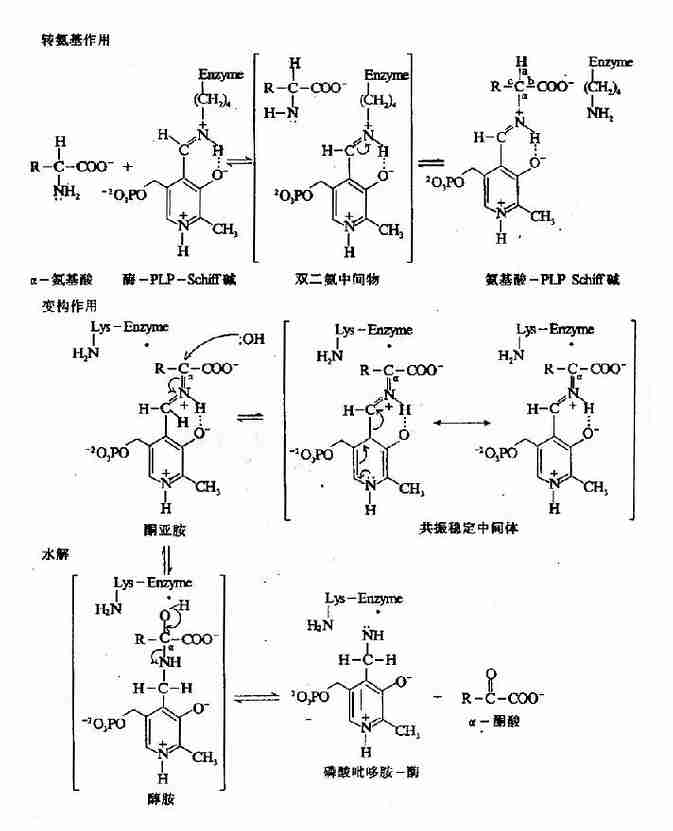
图7-3 PLP依赖的酶促转氨基反应机理
第一阶段:氨基酸转变为酮酸
(1)氨基酸的亲核性NH2基团作用于酶PLp Schiff碱C原子,通过转亚氨基反应(transimination ortransSchiffigation)形成一种氨基酸PLp Schiff碱,同时使酶分子中赖氨酸的NH2基团复原。
(2)通过酶活性位点赖氨酸催化去除氨基酸α氢,并通过一共振稳定的中间产物在PLP第4位C原子上加质子,将氨基酸桺Lp Schiff碱分子重排为一个α酮酸PMP schiff碱。
(3)水解生成PMP和α-酮酸。
第二阶段:α-酮酸转变为氨基酸
为完成转氨反应循环,辅酶必需由PMP形式转变为E-PLp-Schiff形式,此过程亦包括三步,为上述反应的逆过程。
(1)PMP与一个α-酮酸作用形成α-酮酸-Schiff碱。
(2)分子重排,α-酮酸-PMp-Schiff碱变为氨基酸-PLP-Schiff碱。
(3)酶活性位点赖氨酸ω-NH2基团攻击氨基酸-PLp-Schiff碱,通过转亚氨基生成有活性的酶-PLP Schiff碱,并释放出形成的新氨基酸。
转氨基反应中,辅酶在PLP和PMP间转换,在反应中起着氨基载体的作用,氨基在α-酮酸和α-氨基酸之间转移。可见在转氨基反应中并无净NH3的生成。
3.转氨基作用的生理意义
转氨基作用起着十分重要的作用。通过转氨作用可以调节体内非必需氨基酸的种类和数量,以满足体内蛋白质合成时对非必需氨基酸的需求。
转氨基作用还是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变和运输,勾通了机体的糖代谢、脂代谢和氨基酸代谢的互相联系。
(三)联合脱氨基作用
联合脱氨基作用是体内主要的脱氨方式。主要有两种反应途径:
1.由L-谷氨酸脱氢酶和转氨酶联合催化的联合脱氨基作用:先在转氨酶催化下,将某种氨基酸的α-氨基转移到α-酮戊二酸上生成谷氨酸,然后,在L-谷氨酸脱氢酶作用下将谷氨酸氧化脱氨生成α-酮戊二酸,而α-酮戊二酸再继续参加转氨基作用。
L-谷氨酸脱氢酶主要分布于肝、肾、脑等组织中,而α-酮戊二酸参加的转氨基作用普遍存在于各组织中,所以此种联合脱氨主要在肝、肾、脑等组织中进行。联合脱氨反应是可逆的,因此也可称为联合加氨。
2.嘌呤核苷酸循环(purine nucleotide cycle):骨骼肌和心肌组织中L谷氨酸脱氢酶的活性很低,因而不能通过上述形式的联合脱氨反应脱氨。但骨骼肌和心肌中含丰富的腺苷酸脱氨酶(adenylatedeaminase),能催化腺苷酸加水、脱氨生成次黄嘌呤核苷酸(IMP)。
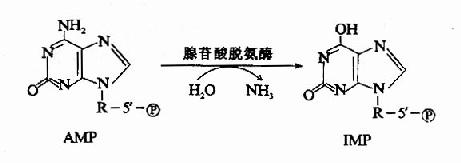
一种氨基酸经过两次转氨作用可将α-氨基转移至草酰乙酸生成门冬氨酸。门冬氨酸又可将此氨基转移到次黄嘌呤核苷酸上生成腺嘌呤核苷酸(通过中间化合物腺苷酸代琥珀酸)。其脱氨过程可用图7-4表示。
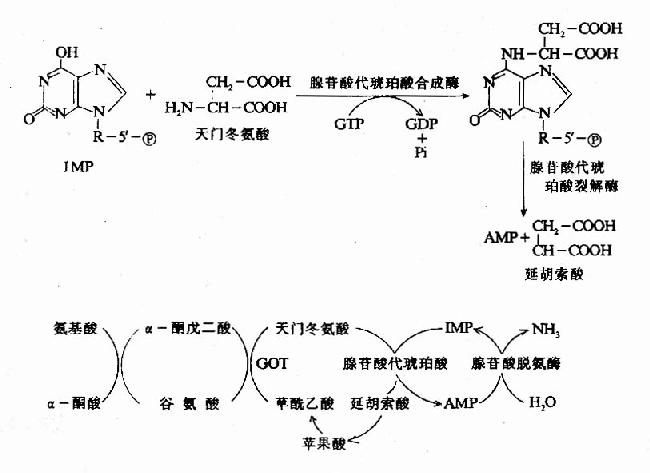
图7-4 腺嘌呤核苷酸循环
目前认为嘌呤核苷酸循环是骨骼肌和心肌中氨基酸脱氨的主要方式。John lowenstein证明此嘌呤核苷酸循环在肌肉组织代谢中具有重要作用。肌肉活动增加时需要三羧酸循环增强以供能。而此过程需三羧酸循环中间产物增加,肌肉组织中缺乏能催化这种补偿反应的酶。肌肉组织则依赖此嘌呤核苷酸循环补充中间产物-草酰乙酸。研究表明肌肉组织中催化嘌呤核苷酸循环反应的三种酶的活性均比其它组织中高几倍。AMP脱氨酶遗传缺陷患者(肌腺嘌呤脱氨酶缺乏症)易疲劳,而且运运后常出现痛性痉挛。
这种形式的联合脱氨是不可逆的,因而不能通过其逆过程合成非必需氨基酸。这一代谢途径不仅把氨基酸代谢与糖代谢、脂代谢联系起来,而且也把氨基酸代谢与核苷酸代谢联系起来。
(四)非氧化脱氨基作用(nonoxidativedeamination)
某些氨基酸还可以通过非氧化脱氨基作用将氨基脱掉。
1.脱水脱氨基 如丝氨酸可在丝氨酸脱水酶的催化下生成氨和丙酮酸。
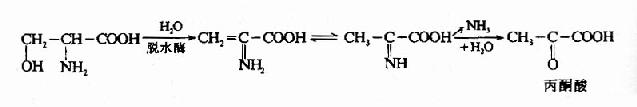
苏氨酸在苏氨酸脱水酶的作用下,生成α-酮丁酸,再经丙酰辅酶A,琥珀酰AoC参加代谢,如下图所示。
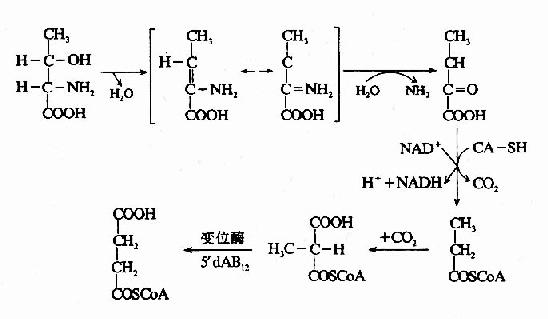
这是苏氨酸在体内分解的途径之一。
2.脱硫化氢脱氨基 半胱氨酸可在脱硫化氢酶的催化下生成丙酮酸和氨。
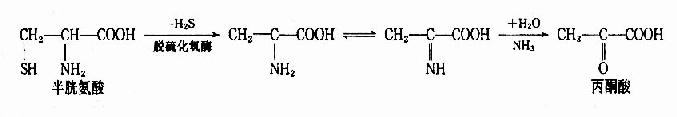
3.直接脱氨基 天冬氨酸可在天冬氨酸酶作用下直接脱氨生成延胡索酸和氨。

| 上一页:第一节 氨基酸的一般代谢 |
| 当前页:一、氨基酸的脱氨基作用 |
| 下一页:二、氨的代谢 |