三、凝血酶原的激活
凝血酶原(Ⅱ,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg-Thr及Arg-Ile处切开,切除N端274个氨基酸残基,余下308个氨基酸残基分成A、B两条肽链,由一个二硫键相连,即为凝血酶(thrombin)。(图10-5)因子Va无酶活性,但可使Xa的活性增强350倍,加速凝血酶的生成。磷脂胶粒与酶(Xa)和底物(凝血酶原)之间借Ca++作为桥相连。因凝血酶原肽链的N未端含有10个γ羧基谷氨酸残基。相邻的羧基可与Ca++形成复合体。另一方面,Ca++又可与磷脂中磷酸基结合,这样使Xa和Va与凝血酶原接触在一起,于是Xa将凝血酶原水解为凝血酶(图10-6)。
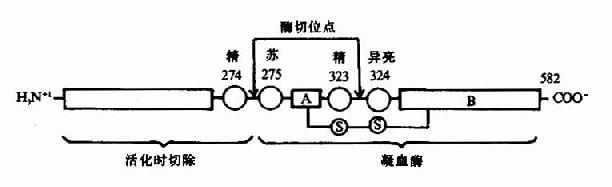
图10-5 因子Xa激活凝血酶原示意图
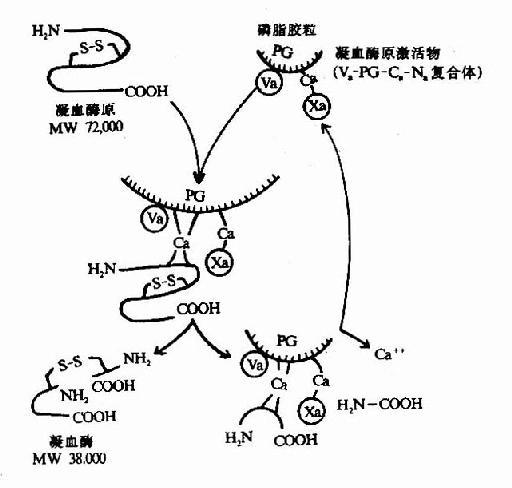
图10-6 凝血酶的生成
凝血酶原及因子Ⅶ、Ⅺ、Ⅹ均由肝合成,合成过程中需要维素K作为辅因子。缺乏Vitk则生成异常凝血酶原,只有正常活性的1?%。研究表明Vitk参与凝血酶原γ羧基谷氨酸的生成。Vitk参与羧基化的机理为:氢醌型Vitk在酶的催化下夺去γC上的一个质子,使γ-C呈阴离子,而和CO2结合。2,3环氧Vitk则在酶催化下被硫辛酸还原而重复利用,因而Vitk在此羧化反应中起辅酶的作用。(图10-7)
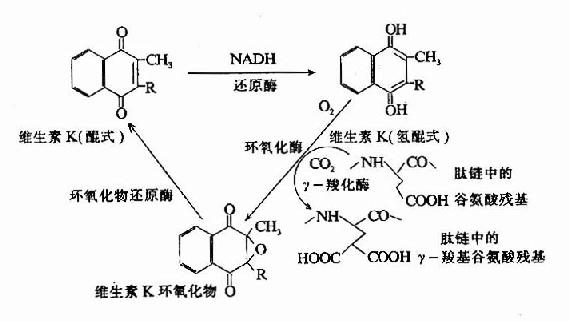
图10-7 维生素K在谷氨酸残基r-羧化反应中的作用(维生素K循环)
| 上一页:(二)外源性途径 |
| 当前页:三、凝血酶原的激活 |
| 下一页:四、纤维蛋白原转变为纤维蛋白 |